长期记忆的形成是大脑如何编码、存储和检索过去经验的基础,对于个体规划未来至关重要。杏仁体(basolateral amygdala, BLA)是情绪体验的中心,对于情绪性记忆,特别是长期恐惧记忆的形成起着关键作用。2月7日发表于Nature上的研究“Spatial transcriptomics reveal neuron–astrocyte synergy in long-term memory”,通过高分辨率的空间和单细胞转录组学分析,研究者能够在分子和细胞层面上阐明BLA在长期记忆中的作用。
研究发现,特定亚群的神经元和星形胶质细胞在记忆形成过程中展现出特定的转录特征,这些特征持续数周,涉及神经肽(neuropeptide)和脑源性神经营养因子(BDNF)信号、MAPK和CREB激活、泛素化途径(ubiquitination pathways)和突触连通性(synaptic connectivity)等关键组成部分。研究中的一个重要发现是,记忆形成时,通过增加Penk表达和降低Tac表达定义的神经元亚群,构成了BLA记忆痕迹(memory engram)的最主要组成部分。这些转录变化不仅通过单细胞RNA测序(single-cell RNA sequencing)观察到,也通过单分子空间转录组学(single-molecule spatial transcriptomics)在完整切片中得到了丰富的空间映射,为记忆痕迹提供了丰富的空间图谱。
此外,空间数据还揭示了这些神经元亚群与相邻的星形胶质细胞相互作用,并且功能实验表明,神经元与星形胶质细胞的相互作用对于编码长期记忆至关重要。通过将这些结果与先前的数据集进行整合,研究者们能够探究大脑不同区域之间在长期恐惧记忆中的区域特异性与普遍性的基因表达变化。这项研究不仅深化了我们对长期记忆形成机制的理解,也为未来针对记忆相关疾病的治疗提供了潜在的分子靶点。

Highlights
神经元与星形胶质细胞的协同作用:
研究揭示了在长期记忆形成中,特定亚群的神经元(neurons)和星形胶质细胞(astrocytes)之间的协同作用,这种相互作用对于编码长期记忆至关重要。这一发现突破了以往主要关注神经元角色的研究范式,强调了星形胶质细胞在记忆形成中的积极作用。
高分辨率的空间和单细胞转录组学分析:
通过结合空间转录组学(spatial transcriptomics)和单细胞转录组学(single-cell transcriptomics)技术,研究提供了记忆痕迹(memory engram)在分子和细胞层面上的详细图谱。这种高分辨率的分析方法能够揭示细胞间复杂的相互作用和转录动态,为理解记忆形成的细胞和分子机制提供了新的视角。
记忆痕迹的空间映射:
研究不仅识别出参与长期记忆的特定神经元和星形胶质细胞亚群,还通过单分子空间转录组学(single-molecule spatial transcriptomics)技术,为这些记忆痕迹提供了丰富的空间图谱。这些空间数据使研究者能够在组织层面上精确地定位记忆相关的细胞和基因表达模式。
长期记忆形成的关键分子机制:
研究发现了多个与长期记忆形成密切相关的分子路径,如神经肽(neuropeptide)信号、脑源性神经营养因子(BDNF)信号、MAPK和CREB激活以及突触连通性(synaptic connectivity)等。这些分子机制的揭示为进一步研究记忆形成的生物学基础和开发相关神经疾病的治疗策略提供了重要线索。
跨大脑区域的记忆机制一致性:
通过与先前数据的整合分析,研究表明不同大脑区域在长期恐惧记忆中使用了相似的分子程序和细胞类型。这种跨区域的一致性加深了我们对记忆网络如何在大脑内协调工作以形成和存储记忆的理解。
Strategies
空间转录组学(Spatial Transcriptomics):
利用空间转录组学技术在组织切片层面上测定基因表达,为记忆痕迹(memory engram)提供空间分布图谱。通过对固定的大脑切片进行高通量的基因表达分析,能够在保持细胞原有空间位置的情况下,测定数千个基因的表达水平,揭示特定神经元亚群与相邻星形胶质细胞的空间相互作用模式。
单细胞转录组学(Single-Cell Transcriptomics):
通过单细胞RNA测序技术分析单个细胞的基因表达,揭示神经元和星形胶质细胞在分子层面的异质性和记忆特异性转录特征。将单个细胞分离并提取其RNA,进行逆转录和扩增,然后通过高通量测序技术分析其基因表达谱。这一方法可以识别出参与长期记忆的特定细胞亚群及其转录活动。
基因编辑(Gene Editing):
通过CRISPR/Cas9等基因编辑技术,验证特定基因在记忆形成中的功能和作用。选择与长期记忆形成密切相关的目标基因,使用CRISPR/Cas9系统对这些基因进行敲除或敲降,然后通过行为学和分子生物学实验评估这些基因编辑对记忆形成的影响。
行为学实验(Behavioral Experiments):
通过行为学测试评估长期记忆的形成,以及基因编辑后对记忆功能的影响。采用恐惧条件化(fear conditioning)实验等经典行为学测试,评估小鼠的记忆形成和记忆召回能力。通过比较野生型和基因编辑后小鼠的行为表现,了解特定基因在记忆过程中的作用。
综合分析(Integrated Analysis):
将空间转录组学和单细胞转录组学数据进行整合分析,揭示长期记忆过程中的细胞类型特异性和区域特异性基因表达模式。利用生物信息学工具对数据进行综合分析,识别记忆过程中的关键基因和信号通路,以及它们在不同细胞类型和大脑区域中的分布和作用。
Advancements
记忆特异性的转录特征:
研究发现,在长期恐惧记忆形成过程中,特定亚群的神经元和星形胶质细胞展现出记忆特异性的持续转录特征。这些特征涉及神经肽(neuropeptide)和脑源性神经营养因子(Brain-Derived Neurotrophic Factor, BDNF)信号、丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase, MAPK)和cAMP反应元件结合蛋白(CAMP Response Element-Binding Protein, CREB)激活、泛素化途径(ubiquitination pathways)和突触连接性(synaptic connectivity)等关键组成部分。
记忆痕迹的空间映射:
通过单分子空间转录组学(single-molecule spatial transcriptomics)技术,研究提供了记忆痕迹(memory engram)的空间图谱,显示出特定神经元亚群与相邻星形胶质细胞的精确空间相互作用模式。
星形胶质细胞与神经元的协同作用:
空间数据揭示了记忆形成时特定神经元亚群与相邻星形胶质细胞之间的互动。功能实验显示,神经元与星形胶质细胞的相互作用对于编码长期记忆至关重要。
长期记忆形成的关键分子机制:
通过单细胞转录组学分析,识别了与长期记忆形成密切相关的分子机制,包括在特定神经元亚群中观察到的Penk基因表达增加和Tac基因表达降低。
跨大脑区域的记忆机制一致性:
通过与先前数据集的整合分析,发现不同大脑区域在长期恐惧记忆中使用了相似的分子程序和细胞类型。这表明长期记忆的形成和存储可能依赖于大脑内不同区域间的协调作用。
星形胶质细胞在记忆形成中的作用:
实验进一步证明了星形胶质细胞在记忆形成中的积极作用。通过基因编辑技术抑制星形胶质细胞的激活,导致记忆形成能力的下降,强调了星形胶质细胞在调节神经元功能和促进记忆形成中的关键角色。
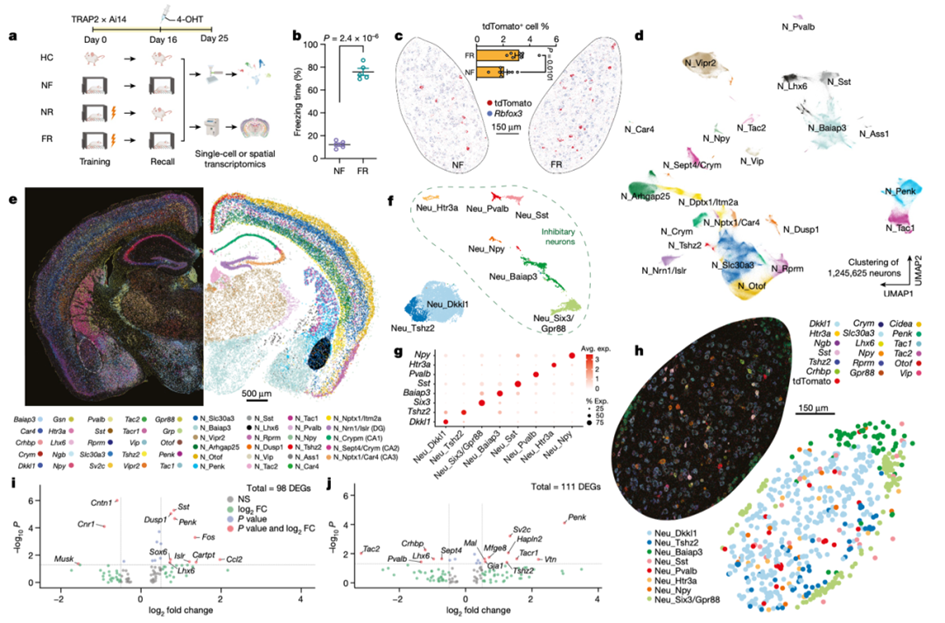
空间转录组学解析了记忆痕迹和与记忆相关的基因(Credit: Nature)
Prospects
具体的分子通路如何调节记忆形成?
虽然研究识别了多个与长期记忆形成相关的关键分子和信号通路,如神经肽、BDNF信号、MAPK和CREB激活等,但这些分子和信号通路如何具体地在细胞内相互作用,共同调控记忆形成的详细机制仍需进一步研究。
星形胶质细胞如何精确调控神经元功能?
研究显示星形胶质细胞在记忆形成中起到关键作用,但星形胶质细胞是如何影响特定神经元亚群的功能,以及它们如何精确调节神经信号传递和突触可塑性仍不完全清楚。
记忆痕迹的长期稳定性机制是什么?
研究揭示了记忆痕迹的空间映射和转录特征,但这些记忆痕迹是如何在长时间内保持稳定的,以及支持记忆长期存储的分子和结构基础仍是一个开放的问题。
不同大脑区域间如何协同工作以形成一致的记忆?
研究发现不同大脑区域在形成长期记忆时存在一致的分子机制,但这些区域如何相互协调,以及信息如何在这些区域间传递以形成完整的记忆网络,需要更深入的研究。
记忆形成与遗忘的平衡如何调节?
记忆的形成和遗忘是大脑信息处理的两个重要方面,研究集中于记忆形成的机制,遗忘过程中相应的分子和细胞机制,以及如何平衡记忆的稳定性与可塑性仍有待探索。
如何将这些发现转化为治疗记忆障碍的策略?
研究为理解记忆形成提供了新的分子目标,但如何将这些基础科学的发现转化为具体的治疗策略,以应对阿尔茨海默病(Alzheimer's disease)等记忆障碍,仍然是一个巨大的挑战。
原文链接
https://www.nature.com/articles/s41586-023-07011-6
Sun W, Liu Z, Jiang X, Chen MB, Dong H, Liu J, Südhof TC, Quake SR. Spatial transcriptomics reveal neuron-astrocyte synergy in long-term memory. Nature. 2024 Feb 7. doi: 10.1038/s41586-023-07011-6. Epub ahead of print. PMID: 38326616.













